The role of m6A methylation in virus infection
(1.College of Veterinary Medicine,Nanjing Agricultural University,Nanjing 210095,China; 2.College of Animal Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
m6A methylation; virus; replication; interaction
基金项目:国家重点研发计划项目(2018YFD0500801); 国家自然科学基金项目(31872471)
作者简介:李晓晗,博士研究生。*通信作者:周斌,博士,教授,主要从事动物分子病毒学研究,E-mail:zhoubin@njau.edu.cn。
-
RNA分子上存在着多种修饰方式,如5-甲基胞嘧啶(m5C)、6-甲基腺嘌呤(m6A)、1-甲基腺嘌呤(m1A)和假尿嘧啶(Ψ)等。而其中RNA分子腺嘌呤第6位氮原子上发生的甲基化修饰,即m6A(N6-methyladenosine)是一种非常重要的表观遗传修饰方式,在干细胞命运决定、肌肉发育、精子形成以及肿瘤发生中都起着重要的作用。在40多年前已经发现病毒RNA中含有m6A修饰,m6A功能的行使主要在甲基转移酶(编码器“Writers”)、去甲基化酶(消码器“Erasers”)和结合蛋白(读码器“Readers”)的参与下进行,他们共同调控m6A的发生。不同种类的病毒,在不同的细胞和组织中产生不同的m6A修饰。而m6A修饰对病毒和宿主RNA的调控机制不尽相同。m6A修饰对宿主的影响在一定程度上与宿主的免疫系统有关。MeRIP-Northern blot和MeRIP-seq等技术的发展帮助加深对该领域的研究。本文综述了m6A甲基化在甲型流感病毒(influenza A virus,IAV)、人类免疫缺陷病毒1型(Human immunodeficiency virus 1,HIV-1)、猴空泡病毒(Simian vacuolating virus 40/Simian virus 40,SV40)、卡波西氏肉瘤相关疱疹病毒(Kaposi's sarcoma-associated herpesvirus,KSHV)、丙型肝炎病毒(Hepatitis C virus,HCV)、乙型肝炎病毒(Hepatitis B virus,HBV)、肠道病毒71型(Enterovirus 71,EV71)、呼吸道合胞病毒(Rous sarcoma virus,RSV)和植物病毒感染中的作用,探讨该甲基化修饰在病毒与宿主相互作用中扮演的重要角色。
It is well known that there are many kinds of modifications on RNA,such as 5-methylcytosine(m5C),6-methyladenine(m6A),1-methyladenine(m1A)and pseudouracil(ψ). Among them,m6A(N6-methyladenosine)is a very important epigenetic modification,which plays an important role in the fate determination of stem cells,muscle development,sperm formation and tumorigenesis. It has been more than 40 years since m6A modification was discovered in viral RNA. The function of m6A modification is regulated by methyltransferase(“Writers”),demethylase(“Erasers”)and binding protein(“Readers”). These three kinds of enzyme regulate the modification of m6A together. On the one hand,the m6A modifications in different types of viruses differ,depending on the types of cells and tissues. m6A modification has different regulatory mechanisms on virus and host RNA respectively. On the other hand,the influence of m6A modification on host is related to the host's immune system to a certain extent. The development of MeRIP-Northern Blot and MeRIP-seq technologies helps deepen researches in this field. This article mainly focuses on the role of m6A modification in the infection of influenza A virus(IAV),Human immune deficiency virus 1(HIV-1),Simian vacuolating virus 40/Simian virus 40(SV40),Kaposi's sarcoma-associated herpesvirus(KSHV),Hepatitis C virus(HCV),Hepatitis B virus(HBV),Enterovirus 71(EV71),Rous sarcoma virus(RSV)and plant virus,and explores the important role that this methylation modification plays in the interaction between the virus and the host. 引言
RNA将基因信息从DNA传递到蛋白质,在中心法则里起着至关重要的作用。病毒RNA在转录后被调控以实现对其功能的控制[1-2]。宿主RNA在病毒感染过程中也存在转录后修饰,从而产生前病毒或抗病毒状态[3-4]。对RNA深入研究后发现了更多的调控机制与功能,其中化学修饰至关重要[5]。19世纪50年代以来,已发现超过100种RNA修饰,广泛分布于各种真核、原核细胞以及病毒中,它们主要存在于核糖体RNA(rRNA)、信使RNA(mRNA)、非编码小RNA(small non-coding RNA)、转运RNA(tRNA)以及长链非编码RNA(lncRNA)等各类RNA上。RNA修饰的种类复杂多样,通过不同修饰实现不同的RNA功能,最终达到遗传信息的多样性[6-7]。目前RNA修饰主要包括6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、1-甲基腺嘌呤(m1A)、5-羟甲基胞嘧啶(m5C)、假尿嘧啶(Ψ)等,这些不同的修饰分别在细胞内具有特有的生物学功能。6-甲基腺嘌呤(m6A)作为真核细胞mRNA中比较常见的修饰方式[8],其功能研究也受到了很大重视。本文探讨m6A在病毒感染中的作用。
1 m6A甲基化概述
1.1 “Writers”蛋白催化m6A修饰形成
甲基转移酶在1992年首次被发现[25],是催化m6A形成的相关蛋白。METTL3作为其重要的组成成分,相对分子质量为70 000,包含2个甲基化的基序,主要定位于细胞核中[26-28],分别为S-腺苷硫氨酸(SAM)结合位点以及具有催化能力的DP-PW功能结构域。通过分析METTL3的同源蛋白METTL14,发现其同样具有S-腺苷硫氨酸结合位点以及具有催化能力的EOOL功能结构域,因此,METTL14也可以说是甲基转移酶复合物的另一个组成成分。在进行催化时,METTL3与METTL14按照1:1比例形成了二聚体,共同发挥作用,这使得METTL3与METTL14的甲基化催化能力得到加强。METTL3和METTL14都定位在核剪接复合体核小斑(nuclear speckle)上,它是细胞核内部的一个亚细胞器,并且有大量的剪切因子会帮助复合体发挥作用。WTAP是Wilms肿瘤1相关蛋白,其在m6A甲基化修饰中同样具有举足轻重的地位,有助于协调甲基转移酶的催化亚基METTL3-METTL14的定位,从而促进m6A甲基化的形成。另外,WTAP还可能利用调控CDK2(cyclin-dependent kinase 2)的mRNA来使RCC细胞增殖,发生癌变,其也可能成为治疗RCC的新的切入点。除此之外,最近对KIAA1429的研究表明其与m6A的形成也有关系,可能是甲基转移酶复合体的新亚基[29]。
1.2 “Erasers”蛋白催化m6A修饰消除
FTO于2011年首次被报道具有m6A去甲基化酶活性,这也让m6A修饰成为了动态可逆的,与DNA或者蛋白质的修饰相类似。随后研究发现,ALKBH5同样也具有m6A去甲基化酶活性[30-31],并且它与FTO是同属一个家族的蛋白。FTO是非血红素Fe(Ⅱ)和α-KG依懒性双加氧酶ALKB蛋白家族的成员,在FTO上含有Fe2+和α-酮戊二酸的结合位点,通过两者共同作用能够将甲基转化为羟甲基并最终消除。FTO基因位于16号染色体,在人体各个发育阶段都会表达,研究发现FTO的主要功能为调节脂肪消耗的速度,调整机体的代谢率,使机体能量保持平衡,它与Ⅱ型糖尿病也有关系[32-33]。FTO可以将m6A氧化为N6-羟甲基腺苷(hm6A)以及N6-甲酰腺苷(f6A),有效去除体外以及细胞内的m6A甲基化修饰。在HeLa和293T细胞系中,FTO基因敲除后mRNA上的m6A水平显著提高,而FTO过表达后的结果恰恰相反。除此之外,通过小鼠试验发现,FTO过表达后,小鼠食量明显增加,并且肥胖率激增[34],而与之相反的是,将小鼠的FTO基因敲除之后,小鼠体重下降明显,生长发育受到严重抑制,机体的能量代谢增加,代谢不平衡[35-36]。因此,FTO具有的m6A去甲基化功能,使m6A修饰呈现动态可逆的形态,这也是RNA上第1个可逆的动态修饰形式。而在FTO发现后不久,ALKBH5则被鉴定为m6A的第2种去甲基化酶。与FTO不同的是,ALKBH5在行使功能时并未形成中间产物,而是直接将m6A逆转为腺苷。除此之外,研究还发现将细胞中的去甲基化酶ALKBH5基因敲除后,m6A水平明显增加,mRNA出核和RNA的代谢也受到了不同程度的影响[37]。在小鼠试验中,将ALKBH5基因敲除后,细胞出现凋亡,减数分裂中期的精母细胞受到影响,从而导致雄性小鼠无法生育[34]。
1.3 “Readers”蛋白通过结合m6A修饰发挥功能
与m6A结合的RNA结合蛋白称为“Readers(读码器)”。这些“Readers”蛋白可以调节靶RNA的稳定性、剪接效率、多聚腺苷酸化、核输出和翻译效率等。研究发现,YTH功能结构域选择性结合RNA上的m6A位点。目前发现的含有YTH功能结构域的“Readers”蛋白主要有YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2共5种[38-39]。其中YTHDF1、YTHDF2以及YTHDF3比较相似,它们都包含一个C端的YTH功能结构域[40],而YTHDC1和YTHDC2则与它们不具有同源性。
研究发现,YTHDF1、YTHDF2和YTHDF3多分布于细胞质当中。YTHDF1不存在序列偏好性,它可以直接调控mRNA的3'UTR区域产生m6A修饰,从而促使mRNA进行翻译[41]。另外,YTHDF1还可以促进底物mRNA与核糖体结合,或者作用于翻译起始因子,介导翻译的发生。YTHDF2与m6A的亲和性要高于YTHDF1和YTHDF3,新检测技术发现YTHDF2有3 000多个靶RNA,它可以通过募集CCR4-NOT腺嘌呤酶复合体来促进mRNA的降解[42]。另外,YTHDF2还与介导mRNA翻译的核糖体存在竞争作用,结合甲基化的mRNA并催化其降解,从而保持细胞中mRNA的稳定。而且,当 mRNA处于m6A修饰状态时,YTHDF2则会负反馈催化mRNA降解。YTHDF3则是与细胞内RNA的代谢有关,是YTHDF1及YTHDF2发挥功能的辅因子,其功能还有待进一步研究。
与YTHDF蛋白不同的是,YTHDC1主要存在于细胞核中,其同样具有多种调节控制作用,可以募集特定的剪切因子调节mRNA的剪切,促进特定转录本衰变。此外,YTHDC1还可以通过丝氨酸/精氨酸剪切因子3使外显子含量增加。YTHDC2蛋白是一个核质蛋白,最近的研究表明,YTHDC2可以通过其解旋酶的作用调节m6A修饰,而更多的功能仍处于未知,有待进一步研究。
m6A是一种比较常见甲基化修饰形式,其发生在腺嘌呤的第6位氮原子上,19世纪50年代时研究者首先在细菌中发现了m6A的存在[9],1974年,研究人员又发现在哺乳动物细胞的mRNA中存在m6A修饰,随后在研究中发现m6A修饰广泛存在于自然界当中,包括哺乳动物、小麦、玉米、果蝇、酵母细胞以及病毒等[10-11]。
以前,修饰核苷酸是通过水解或核酸酶消化放射性标记的RNA,然后进行色谱分析来检测的。现在,基于测序的方法可以绘制m6A穿过细胞转录组[12-14]的图谱。这些方法可以识别含有m6A的特定RNA并确定具体修饰位点。最常用的全转录组m6A定位技术是MeRIP-seq(甲基化RNA免疫沉淀和测序,也称m6A-seq)。mRNA上m6A修饰位点相当保守,主要发生在DRACH(R:嘌呤; A:m6A; H:非鸟嘌呤)序列的腺嘌呤上,其中GGACU是最常见的基序[12-13]。DRACH基序与在Rous肉瘤病毒RNA中最初鉴定的m6A基序([G/A]A*C)一致[15-17]。虽然MeRIP-seq识别m6A富集片段,但没有特定的DRACH靶点。目前所有的m6A映射技术都有几个共同的局限性。它们都依赖于一种抗体,这种抗体会导致检测偏差。来自不同供应商的m6A抗体具有不同的特异性,而这些特异性可以被RNA结构改变[18-19]。因为抗m6A抗体也可以识别类似的修饰2'-O-dimethyladenosine(m6Am)[20-23]。尽管存在局限性,目前转录体范围内的m6A作图方法仍然可以明确m6A在病毒和细胞RNA中的定位。
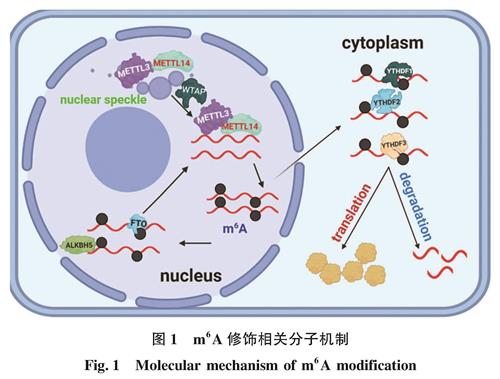
图1 m6A修饰相关分子机制
Fig.1 Molecular mechanism of m6A modificationm6A功能的行使主要在甲基转移酶(编码器“Writers”)、去甲基化酶(消码器“Erasers”)和结合蛋白(读码器“Readers”)的参与下进行,三者共同调控m6A的发生,彼此紧密联系,密不可分(图1)。目前已发现了几种甲基转移酶复合物,主要成分包括甲基化转移酶METTL3(methyltransferase like 3)、METTL14(methyltransferase like 14)、WTAP(Wilm's tumor 1-associated protein)和KIAA1429(VIRMA)等,而已经发现的去甲基化酶有FTO(fat mass and obesity-associated protein,FTO)和ALKBH5(α-ketoglutarate-dependent dioxygenase alkB homolog 5)。在m6A修饰发挥其生物学功能中,结合蛋白的参与发挥了极其重要的作用。目前已知的结合蛋白有YT521-B同源性结构域蛋白(YTH domain-containing proteins),包括 YTHDF1/2/3和YTHDC1/2以及核不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,HNRNP)家族蛋白HNRNPA2B1、HNRNPC和HNRNPG[24]。近年来,RNA修饰的检测技术不断进步,利用这些新技术发现m6A修饰能够在一定程度上对真核生物转录组进行调节,如mRNA的剪接、定位、出核、翻译以及稳定等。更多的m6A修饰机制有待进一步发掘。
2 病毒m6A修饰的研究
2.1 甲型流感病毒(IAV)
甲型流感病毒(IAV)包含1个分段的、单链负义RNA基因组,它是第一个被发现mRNA内部存在m6A修饰的病毒。IAV的mRNA上存在m6A修饰位点约24个,而血凝素(HA)的mRNA上存在8个m6A修饰位点[43]。使用CRISPR/Cas基因编辑技术敲除宿主细胞的甲基转移酶METLL3基因,或者利用3-脱氮腺苷(3-deazaadenosine,3DAA,m6A修饰抑制剂)来抑制m6A修饰,都会使病毒的mRNA和蛋白(NS1和M2)的表达水平降低,最终使病毒复制受到抑制,而过表达YTHDF2则能促进IAV的复制,使成熟的病毒粒子增加。研究发现“Readers”YTHDF1和YTHDF3能够与IAV的RNA结合,但是这种结合不影响IAV的复制以及病毒粒子的产生。进一步研究表明,在小鼠模型中,血凝素(HA)RNA上产生的2种m6A位点同义突变使所产生的2种病毒的复制能力和致病性都有一定程度的降低[44]。这些结果表明IAV的RNA复制与基因的表达都受m6A修饰影响。
2.2 肠道病毒71型(EV71)
肠道病毒71型(EV71)是单链RNA病毒,属于微小病毒科中的肠病毒群,其基因组大小为7.5 kb,强致病性[45-46]。研究发现EV71的RNA上存在m6A修饰,在病毒入侵宿主的过程中,病毒也会反向影响m6A 修饰相关蛋白的表达情况[47]。甲基转移酶METTL3 mRNA水平的下降使EV71的RNA水平下调,而FTO蛋白丰度上升则会使EV71的RNA水平明显上升。如果EV71的RNA上的m6A位点发生突变,会减少成熟的病毒粒子释放。另外,METTL3可以通过对病毒RNA依赖性聚合酶3D的正向调节作用使EV71病毒粒子增加。
2.3 猴空泡病毒(SV40)
猴空泡病毒SV40是一种在细胞核内复制的小型双链DNA病毒,它隶属于多瘤病毒家族,其RNA中也含有m6A。虽然m6A在SV40的mRNA中已存在数十年[48-49],但直到最近才完全了解m6A在病毒mRNA上的确切位置以及它如何调控病毒的复制。m6A位于2个SV40转录本中,研究人员采用PA-m6A-seq方法,在SV40病毒的早期区域发现2个m6A修饰位点,而在SV40病毒的晚期区域发现11个m6A修饰位点。通过过表达“Readers”蛋白YTHDF2和YTHDF3,发现SV40的增殖明显增加,而敲除YTHDF2和“Writers”蛋白METTL3会明显抑制SV40增殖。除此之外,将晚期mRNA上的m6A位点进行突变,SV40的增殖同样受到抑制。这些结果都表明,m6A修饰在SV40复制周期起到了积极的调控作用[50]。
2.4 呼吸道合胞病毒(RSV)
人类呼吸道合胞病毒(RSV)是一种包膜病毒,属于肺炎病毒科。RSV会引起下呼吸道感染,主要针对婴儿、幼儿和免疫功能低下的个体。有研究表明,RSV的基因组、抗原组和mRNA在特定的位点内存在m6A甲基化,并且对HeLa和A549细胞中RSV的复制、基因表达和病毒产生有积极的调节作用。当m6A“Readers”蛋白过度表达时,RSV的复制明显增强,而敲除“Readers”蛋白则抑制了RSV的基因表达和复制。“Erasers”蛋白的情况则正好相反。由于RSV G蛋白基因转录本含有较多的m6A修饰,很可能增强了其稳定性,使更多的翻译成为可能,这可能导致更多的G蛋白插入到病毒粒子中,并增强病毒的组装和感染性病毒粒子的产生。然而,细胞中的G蛋白一部分以可溶性形式释放,从而影响白细胞迁移。增强G蛋白的表达可促进可溶性G蛋白的产生,从而影响机体对RSV的免疫应答。病毒RNA的m6A修饰也可能帮助病毒逃避宿主先天免疫的监视,从而实现有效基因的表达和病毒复制。研究还发现,由于RSV的复制和转录需要持续的蛋白质合成,病毒G蛋白表达的减少将影响所有病毒蛋白的表达,从而导致第2轮病毒整体复制和转录的减少。缺乏特定m6A簇的表达G转录本的重组RSV突变体在A549细胞、原代分化良好的人呼吸道上皮细胞和棉鼠呼吸道细胞中的复制减少,其中1种m6A缺陷型变异体在棉鼠体内毒力大大降低,但仍保持高免疫原性[51]。此外,通过对RSV基因序列分析,宿主m6A可能与RSV核糖核蛋白(RNP)复合物相互作用。这些结果表明,病毒m6A修饰机制可用于减毒活疫苗的设计,可提高减毒活疫苗产量,也为发现广谱抗病毒药物提供新思路。
2.5 人乳头瘤病毒(HPV)
人乳头瘤病毒(HPV)属于乳多空病毒科的乳头瘤空泡病毒A属,是球形DNA病毒,能引起人体皮肤黏膜的鳞状上皮增殖,诱发宫颈癌等疾病。研究发现FTO在宫颈癌组织中经常过表达,并与肿瘤的发生呈正相关,功能性FTO(不是无去甲基化酶活性的突变型FTO)可以调节宫颈癌细胞的增殖和迁移。在机制上,FTO直接与转录因子1(transcription factor 1,E2F1)基因和癌基因Myc mRNA相互作用,抑制FTO可显著抑制这2个重要癌基因的翻译,从而抑制宫颈癌细胞的增殖和迁移。进一步研究表明,FTO可以直接调节 2个重要致癌因子E2F1和Myc的翻译,过表达E2F1或Myc可以充分恢复FTO缺陷细胞的增殖和迁移能力。因此,m6A去甲基酶FTO在调控宫颈癌细胞增殖和迁移中起重要作用,其致癌作用依赖于其去甲基酶活性。这也表明靶向FTO信号转导是宫颈癌治疗的一种有前途的策略[52]。
2.6 寨卡病毒(ZIKV)
研究发现RNA甲基转移酶的缺失或过度表达能够影响ZIKV的复制,RNA甲基转移酶的缺失,可以使病毒复制增加; 与之相对应的是,RNA去甲基化酶的消除可以抑制病毒的复制。另外,宿主RNA甲基转移酶机制是ZIKV的负转录后调节因子RNA甲基转移酶能够加速病毒裂解,使转录本降解。m6A对病毒复制的影响可能是通过调节病毒RNA代谢进行的,YTHDF家族蛋白调节m6A修饰RNA的稳定性,其可以与ZIKV RNA结合,并且沉默后增加了ZIKV的复制。对宿主mRNA的m6A甲基化分析表明,ZIKV感染改变了mRNA中的m6A位置以及由甲基转移酶修饰的靶基因[53]。
2.7 乙型肝炎病毒(HBV)
乙型肝炎病毒(HBV)的基因组为DNA,通过前基因组RNA(pregenomic RNA,pg RNA)这样的形式实现自身的复制。大部分pg RNA会被翻译成病毒蛋白,其余部分经过pol亚基和core亚基包裹后进行逆转录,产生成熟的核衣壳。分别对慢性乙型肝炎患者的肝组织以及HBV表达的细胞中的HBV RNA进行检测,在其中均发现m6A修饰的存在。另外,“Readers”蛋白YTHDF2和YTHDF3都能够结合HBV RNA[54]。将HBV蛋白中的“Writers”蛋白METTL3和METTL14的基因沉默之后,HBV蛋白的表达与RNA的稳定性都有所增加,而pg RNA的逆转录会受到抑制; 与之对应的是,将HBV蛋白中的“Erasers”蛋白FTO的基因沉默之后,HBV蛋白的表达与RNA的稳定性都有所降低,而pg RNA的逆转录则会增加。
2.8 丙型肝炎病毒(HCV)
METTL3—METTL14至少有一部分存在于细胞质中,在细胞质中它可以与病毒RNA相互作用并使其甲基化[55]。在HCV感染的细胞内,核孔复合蛋白被招募到HCV复制的膜位点,同时METTL3也被招募到该位点,这可能源于METTL3上存在核定位信号[56]。在HCV感染期间,m6A修饰对感染病毒粒子的产生存在负调控。具体来说,HCV RNA的E1基因中的m6A抑制病毒RNA包装成感染性颗粒,可能是通过促进与m6A结合的YTHDF蛋白和被m6A排斥的HCV核心蛋白之间的竞争实现的。有趣的是,在HCV感染期间,这些YTHDF蛋白重新定位到脂滴处的病毒离子组装位点。这些发现支持了YTHDF蛋白识别m6A对病毒RNA包装有抑制作用的观点。事实上,细胞内的HCV RNA比胞外病毒相关的HCV RNA[55,57]含有更多的m6A修饰。这表明HCV以及其他可能的黄病毒RNA m6A修饰在不同的生命周期可能是不同的。然而,在不同的生命周期,导致这种差异性改变的机制仍然是未知的。重要的是,虽然改变m6A的表达可以改变HCV水平,但它并不影响几个已知的干扰素(interferon,IFN)刺激基因(interferon stimulated genes,ISG)的表达,这表明m6A水平的改变不会影响HCV感染产生的整体抗病毒反应。
2.9 卡波氏肉瘤相关疱疹病毒(KSHV)
KSHV是一种致癌的疱疹病毒。研究发现,KSHV通过潜伏基因的表达实现在宿主细胞内的潜伏感染。与其他疱疹病毒一样,KSHV的感染存在潜伏感染(latent infection)和裂解复制(lytic replication)2种时期。在裂解复制中,KSHV按照早期基因到晚期基因的顺序依次表达蛋白。KSHV的生命周期受到m6A修饰影响,表现为KSHV的 mRNA的m6A修饰水平在裂解复制时会显著提高[58]。将KSHV基因组中的去甲基化蛋白FTO基因沉默之后,裂解基因的表达量增加,而将KSHV基因组中的甲基化转移酶METTL3基因沉默之后,裂解基因的表达量则会减少; 同样,利用甲氯酚那酸(meclofenamic acid,MA)抑制“Erasers”蛋白FTO的活性后,其裂解基因的表达量增加,而使用DAA抑制m6A修饰则会使裂解基因表达量减少,病毒粒子产生随之减少。Hesser等[59]报道,感染KSHV后细胞的m6A水平明显升高,但是沉默不同细胞系的m6A修饰,将对KSHV的基因表达产生不同影响。在iSLK.219和iSLK.BAC16细胞中,METTL3和“Readers”YTHDF2蛋白表达水平降低,会影响转录激活因子ORF50,使其蛋白丰度下降,最终KSHV的滴度下降,这表明m6A可以促进KSHV的增殖。与之对应的是,KSHV感染B细胞后,METTL3或者“Readers”YTHDF2蛋白的缺失则会让ORF50蛋白丰度增加,进而使KSHV滴度增加。虽然不同细胞系中m6A修饰对KSHV的影响不同,但是可以表明m6A通过ORF50来调控KSHV的复制。另外,最新的研究表明,KSHV RNA在病毒的潜伏期和裂解复制期内都存在大量的m6A修饰,并且这些修饰在不同细胞类型和感染系统中高度保守。另外,“Readers”蛋白YTHDF2还可以通过促进病毒RNA降解,进而抑制KSHV裂解复制。这些结果说明在KSHV生命周期中,m6A修饰有至关重要的作用。
2.10 人类免疫缺陷病毒Ⅰ型病毒(HIV-1)
HIV-1为人类免疫缺陷病毒Ⅰ型病毒,是一种感染人类免疫系统细胞的慢病毒,属于逆转录病毒。在HIV-1进行复制时,m6A修饰对mRNA的帽子依赖、非依赖性翻译、出核和选择性剪切等过程起着至关重要作用。因此,m6A修饰在HIV-1感染中很可能发挥重要作用[60]。
m6A 甲基化的RNA免疫沉淀(m6A-methylated RNA immunoprecipitation,MeRIP)和光交联辅助的m6A测序(photo-crosslinking-assisted m6A-sequencing,PA-m6A-Seq)结果显示,HIV-1的RNA含有m6A修饰并且m6A在3'UTR富集[61]。HIV-1感染后宿主与病毒mRNA的m6A丰度都会升高。通过shRNA介导甲基化转移酶METTL3、METTL14以及去甲基化酶ALKBH5基因的沉默,发现METTL3和METTL14的沉默可以使GP120、p24 RNA水平降低,而沉默ALKBH5使这2个基因的RNA水平升高[62],说明m6A的修饰水平与GP120和p24 RNA丰度呈正相关。另外,发生在HIV-1 Rev响应原件(Rev responsive element,RRE)RNA茎环Ⅱ区域的保守腺苷(A7883)的m6A修饰可以促进Rev蛋白与其结合,进而促使RNA向胞质转运,最终使HIV-1增殖。此外,Tirumuru等[63]观察到在HeLa细胞中存在过表达m6A识别蛋白YTHDF1、YTHDF2和YTHDF3时,HIV的滴度降低,其中YTHDF2的抑制作用最为显著,其效果类似于叠氮胸苷(zidovudine,AZT),说明m6A识别蛋白YTHDF1、2和3可能通过某种机制抑制HIV的复制。
2.11 植物病毒
与哺乳动物相比,目前对植物病毒m6A修饰功能的研究很少,而植物病毒对植物正常生长发育有严重的威胁。Martínez-Pérez等[64]通过酵母双杂交筛选,利用拟南芥苜蓿花叶病毒(Alfalfa mosaic virus,AMV)和衣壳蛋白(capsid protein,CP)的相互作用,鉴定去甲基化酶ALKB家族的成员atALKBH9B。另外,研究表明,在拟南芥转录体宽谱超过2/3的mRNA[65]中检测到了m6A修饰。拟南芥中的METTL3同系物在植物发育中起着关键作用[66-67]。此外,拟南芥FIP37蛋白是WTAP的一个植物同源物,在体内外与MTA相互作用,是介导茎分生组织mRNA m6A修饰的关键[66,68]。然而,目前还没有脱甲基酶或YTHDF影响植物病毒活性的描述。拟南芥基因组包含13个大肠杆菌AlkB(atALKBH1-10B)同源基因[68]。尽管这些蛋白质的功能特性尚未见报道,但亚细胞定位研究表明,除了定位于叶绿体的atALKBH1D和仅定位于细胞质的atALKBH9B之外,所有这些蛋白质都显示出核质定位模式[69]。有趣的是,在不同植物病毒复制酶基因的ORF中发现了AlkB结构域。这些结构域在体外能够从RNA和DNA中去除m1A和m3C修饰,这表明复制酶蛋白在逆转病毒基因组甲基化修饰中的作用。除此之外,研究[64]发现AMV和CMV这2个雀麦花叶病毒科成员的基因组中同样有m6A的存在,并且将去甲基化酶atALKBH9B突变后,AMV基因组中m6A水平明显上升。进一步研究表明,atALKBH9B与小干扰RNA(siRNA)的组成部分SGS3以及P-body中的降解酶DCP1完全重叠,这也表明m6A修饰对AMV复制的调节很可能是通过mRNA的沉默和衰减来进行的。
虽然病毒RNA的m6A修饰是在几十年前发现的,但近两年来仅有少量研究证据表明,这种普遍存在的动态表位转录现象可能在许多病毒中发挥着调节作用。不同病毒的m6A修饰对其复制的影响不尽相同(图2)。IAV、EV71、SV40、RSV、HPV等病毒的m6A修饰对其复制有促进作用; 而AMV、AIKV、HBV、HCV、KSHV等病毒的m6A修饰则产生了完全相反的影响; 而像HIV-1等病毒,m6A修饰对其复制的影响还有待进一步研究。精确的m6A定位方法的发展为我们对m6A功能的理解奠定了基础。在病毒生命周期中,去除宿主m6A机制和取消特定位点的甲基化仍然是确定m6A功能不可缺少的方法。然而,特定修饰位点的靶向甲基化或去甲基化,虽然在技术上具有挑战性,但毫无疑问可以更好阐明m6A的功能。此外,m6A在抑制其他病毒的同时积极调节某些病毒复制的能力仍然是一个关键问题,值得我们不断去探索研究。同样,目前还不清楚宿主表位编码组的变化,无论是促进还是抑制病毒复制,在调节病毒感染方面都起着重要作用。而这些关键问题的解决可能会让我们更深一步理解m6A在病毒-宿主相互作用中发挥的作用,并给病毒研究带来新的启示。
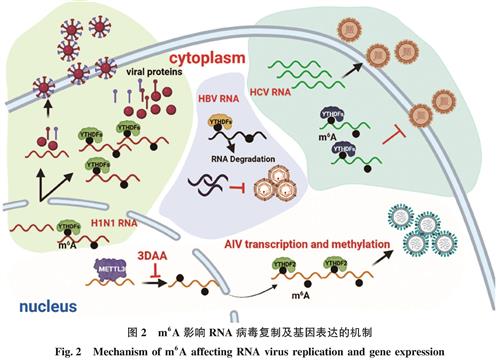
图2 m6A影响RNA病毒复制及基因表达的机制
Fig.2 Mechanism of m6A affecting RNA virus replication and gene expression
大约40多年前,人们在对病毒RNA进行研究时发现,某些病毒RNA中含有m6A修饰,例如甲型流感病毒(influenza A virus,IAV)、猴病毒40(Simian virus 40,SV40)、人类呼吸道合胞病毒(Human respiratory syncytial virus,RSV)和腺病毒(Adenovirus)等。由于当时对m6A的研究较少,专业知识相对匮乏,相关试验技术不成熟,所以对于病毒RNA中m6A功能的研究缺乏突破性进展。近些年来,随着MeRIP-Northern Blot和MeRIP-Seq等技术的发展,病毒RNA的m6A修饰机制被逐步解析出来。目前已发现人类免疫缺陷病毒(Human immunodeficiency virus 1,HIV-1)、黄病毒(Flavivirus)、IAV、SV40、卡波西氏肉瘤相关疱疹病毒(Kaposi's sarcoma-associated herpesvirus,KSHV)和乙型肝炎病毒(Hepatitis B virus,HBV)的RNA中均存在m6A修饰,并且m6A修饰对于病毒的复制和病毒相关基因的表达都有着至关重要的影响(表1)。

表1 m6A对不同病毒复制的调控作用
Table 1 Regulation of m6A on replication of different viruses3 m6A修饰对免疫反应的影响
免疫系统是机体的安全卫士,是高等生物抵御病毒入侵的重要保护屏障,对清除病原体起着至关重要的作用。目前对于m6A修饰在免疫系统中的作用和m6A修饰在宿主与病原体中的相互作用研究还比较少。先天性免疫反应是快速和非特异性的,作为应对病毒感染的第一反应,先天免疫系统通过区分病原体和宿主核酸,对病毒感染提供第一反应。研究发现,RNA m6A在先天免疫应答中的作用仍然是矛盾的。一方面,RNA解旋酶家族成员DDX46与ALKBH5相互作用,使m6A标记的抗病毒转录本( MAVS、TRAF3和TRAF6)去甲基化,导致它们在细胞核内滞留并抑制了之后的翻译。因此,DDX46抑制病毒感染后的Ⅰ型干扰素(IFN-Ⅰ)信号级联反应,这提示m6A在先天性抗病毒反应中起积极作用[70]。另一方面,m6A调节是IFN-Ⅰ诱导的先天性免疫反应中的负调节因子。在病毒感染过程中,甲基化转移酶METTL3和读码器蛋白YTHDF2的过表达提高了干扰素IFNβ转录本上的m6A修饰水平,降低了它的稳定性,抑制了IFNβ的表达和免疫应答[71]。除了宿主转录物外,含有核苷酸修饰的病毒核糖核酸可以中断胞浆内维甲酸诱导基因Ⅰ(retinoic acid-inducible geneⅠ,RIG-Ⅰ)样的先天免疫信号传导[72]。另外,Liu等[73]研究水泡型口炎病毒(Vesicular stomatitis virus,VSV)感染小鼠腹腔巨噬细胞后宿主细胞m6A水平的变化,发现宿主细胞可以通过削弱ALKBH5的去甲基化活性来积极对病毒感染做出反应,这会导致增加的酮戊二酸脱氢酶(a-ketoglutarate dehydrogenase,OGDH)mRNA衰减,使OGDH蛋白表达下降,从而对细胞代谢状态进行重编程而使得宿主对病毒感染产生不依赖于IFN-I的抵抗力。下降的OGDH表达限制三羧酸循环并减少病毒复制所需的衣康酸的产生,因而限制宿主细胞中的病毒感染,证明RNA表观遗传与细胞代谢协同抵御病毒感染,为病毒感染性疾病的干预与治疗提供潜在药物靶点。
此外,m6A在自适应免疫中也发挥很大作用。有研究表明[74],m6A“Readers”蛋白YTHDF1参与从树突状细胞(DC)到CD+8 T细胞的抗原递呈。在机制上,YTHDF1促进溶酶体组织蛋白酶的翻译,破坏肿瘤新抗原的交叉表达和CD+8 T细胞的交叉启动,导致肿瘤免疫逃逸,YTHDF1的缺失会抑制肿瘤的发展。T细胞中METTL3的缺失减弱了细胞因子信号(SOCS)家族基因抑制物、Janus激酶(JAK)、信号转导及转录激活物(STAT)蛋白的必要抑制剂的mRNA衰减。因此,m6A通过靶向白细胞介素7(IL-7)诱导的JAK/STAT5信号途径,调节T细胞在适应性免疫应答中的稳态分化能力。病毒mRNA的快速复制对于它们在宿主免疫反应被激活之前的传播至关重要,可以使病毒能够劫持宿主蛋白质以绕过免疫系统,进而达到存活的目的。m6A通过靶向Naive CD+4 T细胞中IL-7/STAT5/SOCS信号通路中的信号分子mRNA来调控Naive CD+4 T细胞的分化,从而维持免疫系统的动态平衡。METTL3作为重要的甲基转移酶,调控m6A和宿主RNA甲基化修饰,在CD+4 T细胞中特异性敲除METTL3基因后Naive CD+4 T细胞的分化受阻,抑制了T细胞过继转输诱导的肠炎发生,为T细胞内稳态和信号依赖的mRNA降解提供了新的分子机制[74]。
4 结语
m6A 是真核生物中最丰富的RNA 修饰,越来越多的研究表明其对病毒的复制有着重要的影响。随着对其修饰机制的深入研究,发现m6A对RNA水平的调控越来越复杂多样。m6A修饰功能的行使是通过编码器“Readers”蛋白来实现的:一方面,“Readers”蛋白能够促进m6A 修饰mRNA的翻译; 另一方面,在某些情况下,“Readers”蛋白也会通过降低靶mRNA的稳定性,促进其降解。因此,有关其调控功能的具体机制还有待进一步探究。而对m6A修饰在病毒复制过程中调控机制的研究表明,m6A修饰对于病毒复制的调控是通过影响病毒mRNA或基因组RNA的稳定来实现的[75]。在m6A修饰过程中,将甲基化转移酶基因沉默之后,HIV和IAV复制会受到抑制; 反之,将去甲基化酶基因沉默之后,则促进HIV和AIV的复制,但是在HCV和ZIKV上进行同样的试验,却产生了相反的结果。虽然同样是RNA病毒,都具有m6A修饰,但是结果大相径庭,可见m6A对不同病毒的调控是不同的,可能受到许多因素的影响[76]。此外,病毒RNA的高甲基化使部分病毒能够成功躲避免疫系统的识别,那么是否有某些方法检测这些生物体异常变化还需要进一步的研究。总的来说,m6A通过调节特定的RNA来调节病毒复制的许多方面,有时依赖于组织或细胞类型[77]。今后研究在病毒感染期间的m6A时应着重于特定修饰位点在单个转录本中的作用、修饰的时间动态以及新发现的m6A“Readers”蛋白及其功能。此外,还应该进行体外细胞试验,或加入动物模型等,例如利用甲基化转移酶基因METTL3、METTL14或者是去甲基化酶FTO基因敲除的鼠进行更深一步的研究。到目前为止,我们对m6A在病毒感染中的作用认识较少,具体的机制需要进一步研究发掘。
-
参考文献
- [1] Schwerk J,Jarret A P,Joslyn R C,et al. Landscape of post-transcriptional gene regulation during hepatitis C virus infection[J]. Current Opinion in Virology,2015,12:75-84.
- [2]Li M M H,MacDonald M R,Rice C M. To translate,or not to translate:viral and host mRNA regulation by interferon-stimulated genes[J]. Trends in Cell Biology,2015,25(6):320-329.
- [3]Batra R,Stark T J,Clark E,et al. RNA-binding protein CPEB1 remodels host and viral RNA landscapes[J]. Nature Structural & Molecular Biology,2016,23(12):1101-1110.
- [4]Mino T,Takeuchi O. Post-transcriptional regulation of immune responses by RNA binding proteins[J]. Proceedings of the Japan Academy Ser B,Physical and Biological Sciences,2018,94(6):248-258.
- [5]Fu Y,Dominissini D,Rechavi G,et al. Gene expression regulation mediated through reversible m6A RNA methylation[J]. Nature Reviews Genetics,2014,15(5):293-306.
- [6]Maden B E H. The numerous modified nucleotides in eukaryotic ribosomal RNA[J]. Progress in Nucleic Acid Research and Molecular Biology,1990,39:241-303.
- [7]Wang X,Lu Z K,Gomez A,et al. N6-methyladenosine-dependent regulation of messenger RNA stability[J]. Nature,2014,505(7481):117-120.
- [8]Yue Y,Liu J,He C. RNA N6-methyladenosine methylation in post-transcriptional gene expression regulation[J]. Genes Dev,2015,29(13):1343-1355.
- [9]Xuan J J,Sun W J,Lin P H,et al. RMBase v2.0:deciphering the map of RNA modifications from epitranscriptome sequencing data[J]. Nucleic Acids Research,2018,46(D1):D327-D334.
- [10]Levis R,Penman S. 5'-terminal structures of poly(A)+cytoplasmic messenger RNA and of poly(A)+ and poly(A)-heterogeneous nuclear RNA of cells of the dipteran Drosophila melanogaster[J]. Journal of Molecular Biology,1978,120(4):487-515.
- [11]Clancy M J. Induction of sporulation in Saccharomyces cerevisiae leads to the formation of N6-methyladenosine in mRNA:a potential mechanism for the activity of the IME4 gene[J]. Nucleic Acids Research,2002,30(20):4509-4518.
- [12]Dominissini D,Moshitch-Moshkovitz S,Schwartz S,et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq[J]. Nature,2012,485(7397):201-206.
- [13]Meyer K D,Saletore Y,Zumbo P,et al. Comprehensive analysis of mRNA methylation reveals enrichment in 3' UTRs and near stop codons[J]. Cell,2012,149(7):1635-1646.
- [14]Vandivier L E,Gregory B D. Reading the epitranscriptome:new techniques and perspectives[J]. The Enzymes,2017,41:269-298.
- [15]Kane S E,Beemon K. Inhibition of methylation at two internal N6-methyladenosine sites caused by GAC to GAU mutations[J]. Journal of Biological Chemistry,1987,262(7):3422-3427.
- [16]Kane S E,Beemon K. Precise localization of m6A in Rous sarcoma virus RNA reveals clustering of methylation sites:implications for RNA processing[J]. Molecular and Cellular Biology,1985,5(9):2298-2306.
- [17]Dimock K,Stoltzfus C M. Sequence specificity of internal methylation in B77 avian sarcoma virus RNA subunits[J]. Biochemistry,1977,16(3):471-478.
- [18]Liu B,Merriman D K,Choi S H,et al. A potentially abundant junctional RNA motif stabilized by m6A and Mg2+[J]. Nature Communications,2018,9:2761.
- [19]Zeng Y,Wang S Y,Gao S S,et al. Refined RIP-Seq protocol for epitranscriptome analysis with low input materials[J]. PLoS Biology,2018,16(9):e2006092.
- [20]Akichika S,Hirano S,Shichino Y,et al. Cap-specific terminal N6-methylation of RNA by an RNA polymerase Ⅱ-associated methyltransferase[J]. Science,2018,363(6423):eaav0080.
- [21]Sun H X,Zhang M L,Li K,et al. Cap-specific,terminal N6-methylation by a mammalian m6Am methyltransferase[J]. Cell Research,2019,29(1):80-82.
- [22]Mauer J,Luo X B,Blanjoie A,et al. Reversible methylation of m6A m in the 5' cap controls mRNA stability[J]. Nature,2017,541(7637):371-375.
- [23]Linder B,Grozhik A V,Olarerin-George A O,et al. Single-nucleotide-resolution mapping of m6A and m6Am throughout the transcriptome[J]. Nature Methods,2015,12(8):767-772.
- [24]Meyer K D,Jaffrey S R. Rethinking m6A readers,writers,and erasers[J]. Annual Review of Cell and Developmental Biology,2017,33:319-342.
- [25]Tuck M T. Partial purification of a 6-methyladenine mRNA methyltransferase which modifies internal adenine residues[J]. The Biochemical Journal,1992,288(Pt 1):233-240.
- [26]Liu J Z,Yue Y N,Han D L,et al. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation[J]. Nature Chemical Biology,2014,10(2):93-95.
- [27]Slobodin B,Han R Q,Calderone V,et al. Transcription impacts the efficiency of mRNA translation via co-transcriptional N6-adenosine methylation[J]. Cell,2017,169(2):326-337.e12.
- [28]Huang H L,Weng H Y,Zhou K R,et al. Histone H3 trimethylation at lysine 36 guides m6A RNA modification co-transcriptionally[J]. Nature,2019,567(7748):414-419.
- [29]Schwartz S,Mumbach M R,Jovanovic M,et al. Perturbation of m6A writers reveals two distinct classes of mRNA methylation at internal and 5' sites[J]. Cell Reports,2014,8(1):284-296.
- [30]Jia G F,Fu Y,Zhao X,et al. N6-methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO[J]. Nature Chemical Biology,2011,7(12):885-887.
- [31]Zheng G Q,Dahl J A,Niu Y M,et al. ALKBH5 is a mammalian RNA demethylase that impacts RNA metabolism and mouse fertility[J]. Molecular Cell,2013,49(1):18-29.
- [32]Dina C,Meyre D,Gallina S,et al. Variation in FTO contributes to childhood obesity and severe adult obesity[J]. Nature Genetics,2007,39(6):724-726.
- [33]Frayling T M,Timpson N J,Weedon M N,et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J]. Science,2007,316(5826):889-894.
- [34]Jia G F,Yang C G,Yang S D,et al. Oxidative demethylation of 3-methylthymine and 3-methyluracil in single-stranded DNA and RNA by mouse and human FTO[J]. FEBS Letters,2008,582(23/24):3313-3319.
- [35]Church C,Moir L,McMurray F,et al. Overexpression of FTO leads to increased food intake and results in obesity[J]. Nature Genetics,2010,42(12):1086-1092.
- [36]Fischer J,Koch L,Emmerling C,et al. Inactivation of the FTO gene protects from obesity[J]. Nature,2009,458(7240):894-898.
- [37]McMurray F,Church C D,Larder R,et al. Adult onset global loss of the FTO gene alters body composition and metabolism in the mouse[J]. PLoS Genet,2013,9(1):e1003166.
- [38]Xiao W,Adhikari S,Dahal U,et al. Nuclear m(6)A reader YTHDC1 regulates mRNA splicing[J]. Molecular Cell,2016,61(4):507-519.
- [39]Patil D P,Pickering B F,Jaffrey S R. Reading m6A in the transcriptome:m6A-binding proteins[J]. Trends in Cell Biology,2018,28(2):113-127.
- [40]Bokar J A,Shambaugh M E,Polayes D,et al. Purification and cDNA cloning of the AdoMet-binding subunit of the human mRNA(N6-adenosine)-methyltransferase[J]. RNA,1997,3(11):1233-1247.
- [41]Li A,Chen Y S,Ping X L,et al. Cytoplasmic m6A reader YTHDF3 promotes mRNA translation[J]. Cell Research,2017,27(3):444-447.
- [42]Du H,Zhao Y,He J Q,et al. YTHDF2 destabilizes m6A-containing RNA through direct recruitment of the CCR4-NOT deadenylase complex[J]. Nature Communications,2016,7:12626.
- [43]Narayan P,Ayers D F,Rottman F M,et al. Unequal distribution of N6-methyladenosine in influenza virus mRNAs[J]. Mol Cell Biol,1987,7(4):1572-1575.
- [44]Courtney D G,Kennedy E M,Dumm R E,et al. Epitranscriptomic enhancement of influenza A virus gene expression and replication[J]. Cell Host & Microbe,2017,22,377-386.
- [45]Yee P,Tan S H,Ong K C,et al. Development of live attenuated Enterovirus 71 vaccine strains that confer protection against lethal challenge in mice[J]. Sci Rep,2019,9(1):4805.
- [46]Good C,Wells A I,Coyne C B. Type Ⅲ interferon signaling restricts Enterovirus 71 infection of goblet cells[J]. Science Advances,2019,5(3):eaau4255.
- [47]Hao H J,Hao S J,Chen H H,et al. N6-methyladenosine modification and METTL3 modulate Enterovirus 71 replication[J]. Nucleic Acids Research,2019,47(1):362-374.
- [48]Canaani D,Kahana C,Lavi S,et al. Identification and mapping of N6-methyladenosine containing sequences in Simian virus 40 RNA[J]. Nucleic Acids Research,1979,6(8):2879-2899.
- [49]Finkel D,Groner Y. Methylations of adenosine residues(m6A)in pre-mRNA are important for formation of late Simian virus 40 mRNAs[J]. Virology,1983,131(2):409-425.
- [50]Tsai K,Courtney D G,Cullen B R. Addition of m6A to SV40 late mRNAs enhances viral structural gene expression and replication[J]. PLoS Pathogens,2018,14(2):e1006919.
- [51]Xue M G,Zhao B S,Zhang Z J,et al. Viral N6-methyladenosine upregulates replication and pathogenesis of human respiratory syncytial virus[J]. Nature Communications,2019,10:4595.
- [52]Zou D L,Dong L,Li C Y,et al. The m6A eraser FTO facilitates proliferation and migration of human cervical cancer cells[J]. Cancer Cell International,2019,19:321.
- [53]Lichinchi G,Zhao B S,Wu Y G,et al. Dynamics of human and viral RNA methylation during Zika virus infection[J]. Cell Host & Microbe,2016,20(5):666-673.
- [54]Imam H,Khan M,Gokhale N S,et al. N6-methyladenosine modification of hepatitis B virus RNA differentially regulates the viral life cycle[J]. Proc Natl Acad Sci USA,2018,115(35):8829-8834.
- [55]Gokhale N S,McIntyre A B R,McFadden M J,et al. N6-methyladenosine in Flaviviridae viral RNA genomes regulates infection[J]. Cell Host & Microbe,2016,20(5):654-665.
- [56]Neufeldt C J,Joyce M A,van Buuren N,et al. The hepatitis C virus-induced membranous web and associated nuclear transport machinery limit access of pattern recognition receptors to viral replication sites[J]. PLoS Pathogens,2016,12(2):e1005428.
- [57]McIntyre W,Netzband R,Bonenfant G,et al. Positive-sense RNA viruses reveal the complexity and dynamics of the cellular and viral epitranscriptomes during infection[J]. Nucleic Acids Research,2018,46(11):5776-5791.
- [58]Ye F C,Chen E R,Nilsen T W. Kaposi's sarcoma-associated herpesvirus utilizes and manipulates RNA N6-adenosine methylation to promote lytic replication[J]. Journal of Virology,2017,91(16):DOI:10.1128/jvi.00466-17.
- [59]Hesser C R,Karijolich J,Dominissini D,et al. N6-methyladenosine modification and the YTHDF2 reader protein play cell type specific roles in lytic viral gene expression during Kaposi's sarcoma-associated herpesvirus infection[J]. PLoS Pathogens,2018,14(4):e1006995.
- [60]Riquelme-Barrios S,Pereira-Montecinos C,Valiente-Echeverría F,et al. Emerging roles of N6-methyladenosine on HIV-1 RNA metabolism and viral replication[J]. Frontiers in Microbiology,2018,9:576.
- [61]Kennedy E M,Bogerd H P,Kornepati A V R,et al. Posttranscriptional m6A editing of HIV-1 mRNAs enhances viral gene expression[J]. Cell Host & Microbe,2016,19(5):675-685.
- [62]Lichinchi G,Gao S,Saletore Y,et al. Dynamics of the human and viral m6A RNA methylomes during HIV-1 infection of T cells[J]. Nature Microbiology,2016,1:16011.
- [63]Tirumuru N,Zhao B S,Lu W X,et al. Correction:N6-methyladenosine of HIV-1 RNA regulates viral infection and HIV-1 Gag protein expression[J]. eLife,2017,6. DOI:10.7554/elife.15528.
- [64]Martínez-Pérez M,Aparicio F,López-Gresa M P,et al. Arabidopsis m6A demethylase activity modulates viral infection of a plant virus and the m6A abundance in its genomic RNAs[J]. Proc Natl Acad Sci USA,2017,114(40):10755-10760.
- [65]Wan Y Z,Tang K,Zhang D Y,et al. Transcriptome-wide high-throughput deep m6A-seq reveals unique differential m6A methylation patterns between three organs in Arabidopsis thaliana[J]. Genome Biology,2015,16(1):1-26.
- [66]Zhong S L,Li H Y,Bodi Z,et al. MTA is an Arabidopsis messenger RNA adenosine methylase and interacts with a homolog of a sex-specific splicing factor[J]. The Plant Cell,2008,20(5):1278-1288.
- [67]Bodi Z,Zhong S L,Mehra S,et al. Adenosine methylation in Arabidopsis mRNA is associated with the 3' end and reduced levels cause developmental defects[J]. Frontiers in Plant Science,2012,3:48.
- [68]Shen L S,Liang Z,Gu X F,et al. N6-methyladenosine RNA modification regulates shoot stem cell fate in Arabidopsis[J]. Developmental Cell,2016,38(2):186-200.
- [69]Mielecki D,Zugaj D ,Muszewska A,et al. Novel AlkB dioxygenases:alternative models for in silico and in vivo studies[J]. PLoS One,2012,7(1):e30588.
- [70]Zheng Q L,Hou J,Zhou Y,et al. The RNA helicase DDX46 inhibits innate immunity by entrapping m6A-demethylated antiviral transcripts in the nucleus[J]. Nature Immunology,2017,18(10):1094-1103.
- [71]Winkler R,Gillis E,Lasman L,et al. m6A modification controls the innate immune response to infection by targeting type I interferons[J]. Nature Immunology,2019,20(2):173-182.
- [72]Durbin A F,Wang C,Marcotrigiano J,et al. RNAs containing modified nucleotides fail to trigger RIG-I conformational changes for innate immune signaling[J]. mBio,2016,7(5):DOI:10.1128/mbio.00833-16.
- [73]Liu Y,You Y L,Lu Z K,et al. N6-methyladenosine RNA modification-mediated cellular metabolism rewiring inhibits viral replication[J]. Science,2019,365(6458):1171-1176.
- [74]Li H B,Tong J Y,Zhu S,et al. m6A mRNA methylation controls T cell homeostasis by targeting the IL-7/STAT5/SOCS pathways[J]. Nature,2017,548(7667):338-342.
- [75]Lu W X,Tirumuru N,St Gelais C,et al. N6-methyladenosine-binding proteins suppress HIV-1 infectivity and viral production[J]. Journal of Biological Chemistry,2018,293(34):12992-13005.
- [76]Tirumuru N,Wu L. HIV-1 envelope proteins up-regulate N6-methyladenosine levels of cellular RNA independently of viral replication[J]. J Biol Chem,2019,294:3249-3260.
- [77]Tan B,Liu H,Zhang S,et al. Viral and cellular N6-methyladenosine and N6,2'-O-dimethyladenosine epitranscriptomes in the KSHV life cycle[J]. Nat Microbiol,2018,3:108-120.
- [1] Schwerk J,Jarret A P,Joslyn R C,et al. Landscape of post-transcriptional gene regulation during hepatitis C virus infection[J]. Current Opinion in Virology,2015,12:75-84.
南京农业大学学报
